
ORBITAL
ZONA DE ALTA PROBABILIDAD DE ENCONTRAR UNA PARTÍCULA
La Ecuación de Schorodinger se aplica al átomo de Hidrógeno y se resuelve obteniendo expresiones para y y E del tipo trigonométricas. En estas expresiones aparecen los denominados números cuánticos n, l, y m cuyas combinaciones se asocian a zonas de alta probabilidad de encontrar el electrón u orbitales.
LOS NUMEROS CUANTICOS, SU SIGNIFICADO,
SUS VALORES Y REGLAS DE COMBINACIÓN
n = Número cuántico principal.
Se asocia al tamaño y energía de los orbitales. Puede tomar valores infinitos.
Son: 1,2 3,4,..............a (Es el mismo n del átomo de Bohr)
l = Número cuántico secundario
Se asocia al tipo o forma de los orbitales y toma los valores de n.
Son: 0, 1, 2, 3,......... (n-1)
s p d f
Cada uno de los cuatro primeros valores se asocian respectivamente a las letras que se indican.
m = Numero cuántico magnético.
Se asocia con la orientación espacial de los orbitales y toma la cantidad de valores correspondiente a 2l +1
-1, 0, 1
s = Numero cuántico de spín electrónico.
Se asocia al giro del electrón sobre su eje y solo puede tomar 2 valores, +1/2 y -1/2.
GRÁFICOS DE ORBITALES

Los orbitales px , py y pz

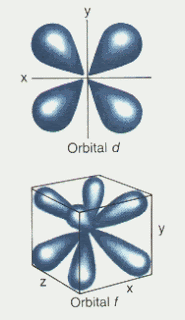
Los 5 orbitales d

Los 7 orbitales f

No hay comentarios:
Publicar un comentario